培地学シリーズ13
2016.04.15
― 緑膿菌菌選択培地<Pseudomonas aeruginosa selective agar>
はじめに
緑膿菌は、1872年にSchroeterによって発見された。1882年にGessardによって、緑に着色した包帯から初めて培養された。緑膿菌という和名は、本菌が創傷感染したときに、緑色の膿が見られたことから名付けられた。Pseudomonas aeruginosaのaeruginosaは<緑青>を意味するギリシア語であり、本菌が作る緑色色素<ピオシアニン>に因んだ名称である。属名のPseudomonasは、ギリシア語のpseudo-(偽の)とmonas(鞭毛を持った単細胞原生生物)に由来する。
食品衛生法では、ミネラルウォーターの製造基準として、殺菌および除菌を行なわない種類では、特定の条件下(二酸化炭素分圧が20℃で98kPa未満)で容器包装された製品あるいは原水で、緑膿菌が検出されないことが必要である。緑膿菌の検査は、アスパラギンブイヨンやmPA-B寒天培地などの選択培地を用いて増菌培養を行なった後、緑膿菌選択培地で純粋分離することになっている。緑膿菌の選択培地として、ナリジキシン酸-セトリミド(NAC)寒天培地、Pseudosel寒天培地、及びナリジキシン酸-セトリミド-カナマイシン(CKNA)寒天培地、クロムアガーPseudomonas培地、緑膿菌選択培地(PASA寒天培地)等がある。今回は緑膿菌選択培地(PASA寒天培地)について紹介する。
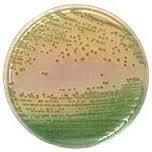
PASA agar(Pseudomonas aeruginosa selective agar、緑膿菌選択培地)
PASA寒天培地は1995年に日本ベクトン・デッキンソン株式会社で開発された緑膿菌選択培地である。(筆者が当時の開発担当責任者であった。)
従来の緑膿菌選択培地では①セトリミド(選択剤)により発育抑制を受ける緑膿菌が存在すること(回収率)や②緑膿菌以外の多種の細菌が発育すること(選択性)等の問題があった。PASA培地は従来の緑膿菌選択培地の回収率と選択性を改良した培地である。選択剤としてはC-390、セフミノクスを用いて緑膿菌以外のグラム陰性菌、グラム陽性菌の多くの細菌の発育を抑制し、発育したコロニーは緑膿菌の特異的なピオシアニンの産生するために緑色のコロニーを形成し、さらに、アミノアセトフェノンの生成により、ブドウ様芳香臭を発する。従って本培地は緑膿菌の選択分離培地と鑑別培地を兼ねることができる。P.aeruginosaとP. fluorecens、B.cepacia、P.putidaが本培地の発育の有無で鑑別が容易である。(これらの菌種は同様の蛍光色素であるフルオレシンを産生する。)
1.組成(精製水1000mlに対して)
| ゼラチン膵消化ペプトン | 10g |
| 獣肉ペプシンペプトン | 10g |
| 酵母エキス | 2g |
| 硫酸マグネシウム | 2g |
| グリセロール | 10g |
| グルタミン酸ナトリウム | 1g |
| 塩化ナトリウム | 5g |
| 緑膿菌選択剤 | |
| ① C-390(9-chloro-9-(4-dieyhylamonpphenyl)-10-phenylacridan) | 30mg |
| ② セフミノクス | 2mg |
| 寒天 | 15g |
pH 7.2±0.2
2.原理
選択剤(C-390,セフミノクス)により緑膿菌以外のグラム陰性菌、グラム陽性菌の発育が抑制される。さらに本培地に発育した緑膿菌はピオシアニンを産生するために青緑色から緑色のコロニーを形成する。<注意:黄緑色(フルオレシン)褐色(ピオルビン)のコロニーを形成する場合もある。>
3.培地組成の役割
カゼイン膵消化ペプトン・獣肉ペプトン
細菌が発育するために必要な栄養素は①窒素源②炭素源である。細菌は蛋白質を分解する能力がないので、タンパク質をポリペプチド・ペプチドの型まで消化すると細菌が分解することができる。この蛋白を消化または分解した物質をペプトンと言う。
ペプトンの種類としてはカゼインペプトン・大豆ペプトン・獣肉ペプトン、心筋ペプトン・ゼラチンペプトン等があるが、本培地では獣肉ペプトン(獣肉ペプシン消化)及びカゼインペプトン(カゼイン膵消化ペプトン)が用いられている。獣肉ペプトンは栄養学的(アミノ酸・ビタミン・炭水化物などの含有量)に優れているために選択性の強い培地には必須のペプトンである。本培カゼインペプトンと獣肉ペプトンが等量含まれている。カゼインペプトンは経済的に優れているので基礎ペプトンとして使用されている。強い選択剤を使用した培地としては栄養学的には若干不足であるが、これは発育したコロニーの大きさ巨大化(拡散)を防ぐためである。<緑膿菌は一般的な培地では拡散したコロニーを形成しやすい。>
酵母エキス
酵母エキスは炭素・窒素源としてよりも,ビタミン・核酸・アミノ酸・有機酸・ミネラル等が豊富に含まれるために緑膿菌の生育促進物質の目的で用いられている。
硫酸マグネシウム・グルタミン酸ナトリウム
緑膿菌は水、クロロホルム溶性のピオシアニンとよばれる非蛍光性の緑青色色素をコロニー周囲に産生することにより推定同定できる。緑膿菌はピオシアニンを産生する唯一の細菌で、蛍光色素のみを産生する他の鑑別できる。硫酸マグネシウム・グルタミン酸ナトリウムはピオシアニン産生の活性剤として用いられている。
グリセロール
グリセロールは細菌が発育するためのエネルギー獲得、炭素源の追加供給(ペプトンに含まれる炭水化物が少ない)目的で添加されております。添加することで細菌の発育が早くなり、同時にピオシアニン産生の促進する作用があります。
<緑膿菌選択剤>
C-390(9-chloro-9-(4-dieyhylamonpphenyl)-10-phenylacridan)
C-390はクロラムフェニコールの合成途中の副産物として精製された抗菌物質である。
しかし、動物やヒトの抗菌薬としては使用されていない。C-390は広域の抗菌スペクトルを有する抗菌薬であり、30mg/Lの濃度では緑膿菌以外のグラム陽性菌、グラム陰性菌、酵母用真菌の発育を阻止する。C-390の含有量は上記基礎培地では30mg/Lでは緑膿菌の発育には影響を受けない。しかし、30mg/Lの濃度で一部のブドウ糖非発酵菌や腸内細菌の発育が阻止できない。(Acinetobacter calcoaceticus、Pseudomonas putrfaciens,Alcaligenes faecalis、Serratia marcescens の発育阻止はできない。)
セフミノクス(Cefminox)
セファマイシン系抗生物質でセファロスポリンに類似の構造である。セファロスポリンと共にセフェム系と呼ばれる。セファマイシンはストレプトミセス属の菌より産生されたたものを起源とするが、合成的に生産されたものも同様に分類する。グラム陰性菌に対する作用が強く、β―ラクタマ―ゼに対して安定である。セフミノクスはC-390では発育が阻止できない緑膿菌以外の菌種の発育を阻止する。
寒天
寒天は培地の固形化剤であります。原料は海藻であるテングサ、オゴノリです。培地用としてはオゴノリが利用されております。主成分はアガロースで糖が直鎖状につながっており、細菌には分解されにくい構造になっております。寒天の内部に水分子を内包しやすく、多量の水を吸収してスポンジ状の構造を形成します。水分を蓄えることができ、栄養分をその中に保持しておける。そのため、微生物の培地に適します。
寒天培地を加熱していくと解ける温度を融点、また解けた寒天が固まる温度を凝固点といいますが、寒天は融点が85~93℃、凝固点が33~45℃です。これも寒天に混ぜる成分により変動します。良い培地か否かは寒天の品質で決まります。品質とは透明度、ゼリー強度、粘度、保水力が優れていることです。
4.使用法<直接分離培養>
①試料原液をPBSで10倍希釈系列を作成する。
②試料0.1mlをPASA寒天培地に接種し、コンラージする。
③35℃、48時間好気性培養する。
④発育コロニー数をカウントする。
⑤緑青色、褐色のコロニーを釣菌し、成書に従い同定試験を実施する。
5.培地の限界
1. 試験試料中に108/m以上の菌数が存在する場合は緑膿菌以外の細菌が発育する。
選択剤として抗生物質を用いている選択培地では高濃度の汚染細菌は阻止されにくい。
特に使用に当たり注意することは、濃厚菌液、コロニーの直接塗抹等で発育性試験は誤った結果を得ることになる。汚染菌の濃度が高い試料は希釈液も同時に培養する必要がある。この現象は本培地に限ったことではなく抗生物質含有培地の限界である。
2.培養時間が48時間以上になると緑膿菌以外の細菌が発育する。
選択剤として抗生物質を用いている選択培地では培養時間が48時間以上になると培地中の抗生物質の抗菌力の劣化により発育する細菌がある。発育の有無の判定は48時間の培養後とする。72時間以上の培養で発育した場合は緑膿菌以外の細菌の可能性を考慮する必要がある。
3.色素産生(ピオシアニン等)しない緑膿菌がある。
緑膿菌の鑑別はピオシアニン色素非産生緑膿菌株は本培地でもクリーム色のコロニーを形成する。
参考文献;
1)吉田眞一、柳雄介編『戸田新細菌学』改訂32版、南山堂、2004年
2)厚生労働省監修、{食品衛生検査指針 微生物編}社団法人日本食品衛生協会(2004)
3)King,Ward.and Raney, 1954. J.Lab.Clin.Med.44:301
4)Lowbury and Collins. 1965. J.Clin.Pathol,18:752
5)Lowbury, 1951. J.Clin.Pathol.4:66
6)築尾嘉章ら. 2008. 花き研報 8;9-12
7)Marold,L,M., et.al. 1981 Appl.Environ.Microbiol. 41:917-981
8)Curry.,J.C.,and G.Euters 1971. Ind.Microbiol.12:163-172
9)坂崎利一:新 細菌培地学講座 近代出版 1988
